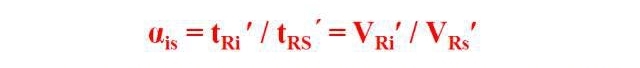la chromatographie, également connue sous le nom d'« analyse chromatographique », « chromatographie », est une méthode de séparation et d'analyse qui a une très large gamme d'applications en chimie analytique, en chimie organique, en biochimie et dans d'autres domaines.
Le fondateur de la chromatographie est le botaniste russe M. Tsvetter.En 1906, le botaniste russe Zvetter publia les résultats de son expérience : Afin de séparer les pigments végétaux, il versa un extrait d'éther de pétrole contenant des pigments végétaux dans un tube en verre contenant de la poudre de carbonate de calcium et l'élua de haut en bas avec de l'éther de pétrole.Étant donné que différents pigments ont des capacités d'adsorption différentes à la surface des particules de carbonate de calcium, lors du processus de lixiviation, différents pigments descendent à des vitesses différentes, formant ainsi des bandes de couleurs différentes.Les composants pigmentaires ont été séparés.Il a nommé cette méthode de séparation chromatographie.
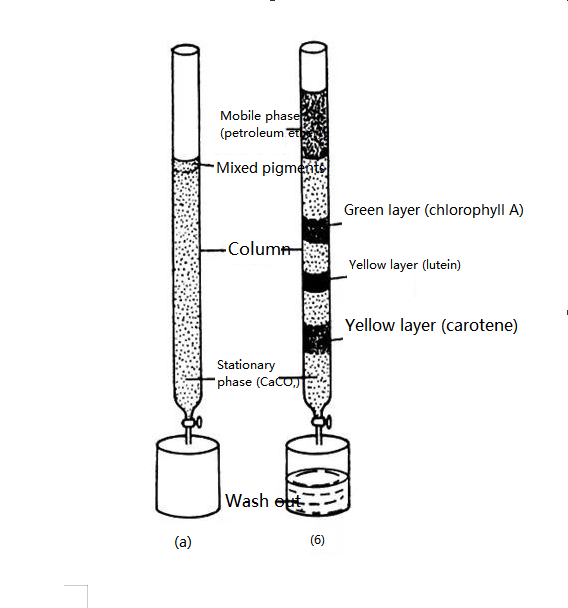
Représentation schématique d'une expérience de séparation des pigments des feuilles d'une plante
Avec le développement continu des méthodes de séparation, de plus en plus de substances incolores deviennent l'objet de séparation, la chromatographie a également progressivement perdu le sens de « couleur », mais le nom est toujours utilisé aujourd'hui.
Classification chromatographique
L'essence de la chromatographie est un processus dans lequel les molécules à séparer sont divisées et équilibrées entre la phase stationnaire et la phase mobile.Différentes substances sont réparties différemment entre les deux phases, ce qui les fait se déplacer à des vitesses différentes avec la phase mobile.Avec le mouvement de la phase mobile, les différents composants du mélange sont séparés les uns des autres sur la phase stationnaire.Selon le mécanisme, il peut être divisé en différentes catégories.
1, selon la classification de l'état physique en deux phases
Phase mobile : Chromatographie en phase gazeuse, chromatographie liquide, chromatographie en fluide supercritique
Phase stationnaire : gaz-solide, gaz-liquide ;Liquide-solide, liquide-liquide
2, selon la forme de classification des phases stationnaires
Chromatographie sur colonne : chromatographie sur colonne garnie, chromatographie sur colonne capillaire, chromatographie sur colonne microgarnie, chromatographie préparative
Chromatographie plane : chromatographie sur papier, chromatographie sur couche mince, chromatographie sur membrane polymère
3, classé selon le mécanisme de séparation
Chromatographie d'adsorption : Différents composants sont séparés selon leurs capacités d'adsorption et de désorption sur des adsorbants
Chromatographie de partage : Les différents composants sont séparés selon leur solubilité dans le solvant
Chromatographie d'exclusion moléculaire : selon la taille de la taille moléculaire de la séparation Chromatographie d'échange d'ions In : différentes composantes de l'affinité pour la séparation par résine échangeuse d'ions
Chromatographie d'affinité : Séparation utilisant la présence d'une affinité spécifique entre macromolécules biologiques
Électrophorèse capillaire : les composants ont été séparés en fonction des différences de mobilité et/ou de comportement de partition
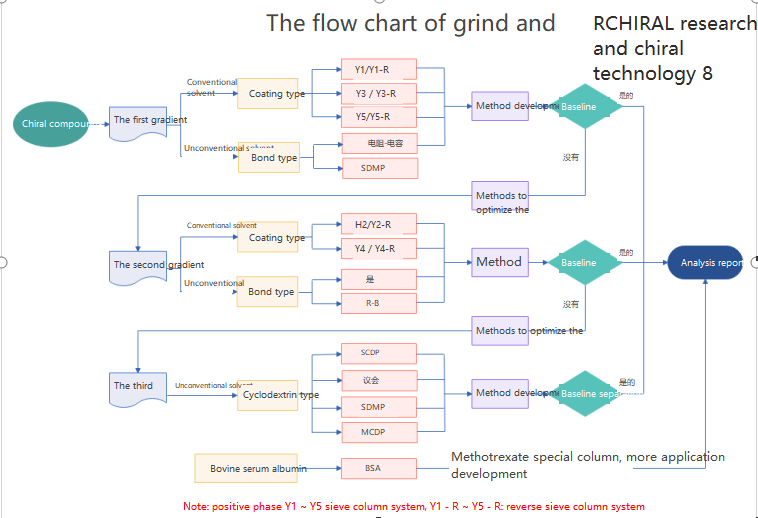
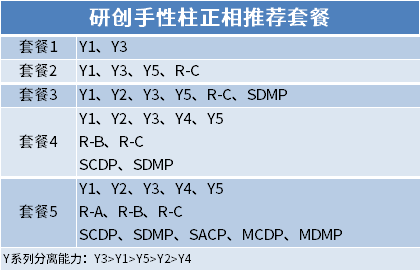
La chromatographie chirale est utilisée pour la séparation et l'analyse des médicaments chiraux, qui peuvent être divisés en trois catégories : méthode de réactif de dérivatisation chirale ;Méthode additive de phase mobile chirale ;Méthode de résolution de phase stationnaire chirale
Terminologie de base pour la chromatographie
Les courbes obtenues en traçant les signaux de réponse des composants après détection de séparation chromatographique en fonction du temps sont appelées chromatogrammes.
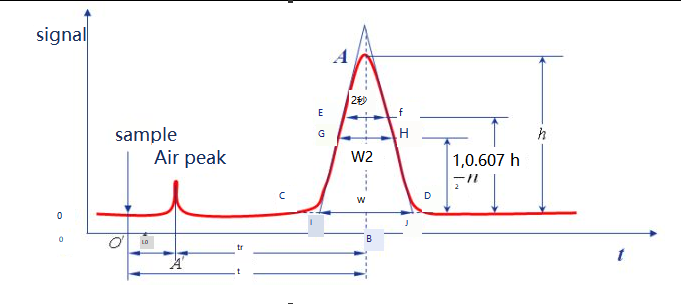
Base de référence :Dans certaines conditions chromatographiques, la courbe du signal généré lorsque seule la phase mobile traverse le système de détection est appelée ligne de base, comme indiqué dans la ligne ot.Lorsque les conditions expérimentales étaient stables, la ligne de base était une ligne parallèle à l’axe horizontal.La ligne de base reflète le bruit de l'instrument, principalement du détecteur, au fil du temps.
Hauteur du pic :la distance verticale entre le point de pic chromatographique et la ligne de base, notée h, comme indiqué dans la ligne AB'.
Largeur de la région :La largeur de la région du pic chromatographique est directement liée à l'efficacité de la séparation.Il existe trois méthodes pour décrire la largeur du pic chromatographique : écart type σ, largeur du pic W et FWHM W1/2.
Ecart type (σ) :σ est la demi-distance entre les deux points d'inflexion sur la courbe de distribution normale, et la valeur de σ indique le degré de dispersion des composants par rapport à la colonne.Plus la valeur de σ est grande, plus les composants de l’effluent sont dispersés et plus l’effet de séparation est mauvais.A l’inverse, les composants de l’effluent sont concentrés et l’effet de séparation est bon.
Largeur du pic W :Les points d'intersection des deux côtés du pic chromatographique sont utilisés comme lignes tangentes, et l'intersection sur la ligne de base est appelée largeur du pic, ou largeur de la ligne de base, qui peut également être exprimée par W, comme le montre la figure IJ.Selon le principe de distribution normale, il peut être prouvé que la relation entre la largeur du pic et l’écart type est W = 4σ.
W1/2 :La largeur du pic à la moitié de la hauteur du pic est appelée FWHM, comme indiqué pour la distance de GH.W1/2=2,355σ, W=1,699W1/2.
W1/2, W sont tous deux dérivés de σ et sont utilisés pour calculer les surfaces des pics en plus de mesurer l'effet colonne.La mesure FWHM est plus pratique et la plus couramment utilisée.
bref résumé
A partir de la courbe de débit de pointe chromatographique, les objectifs suivants peuvent être atteints :
a, L'analyse qualitative a été réalisée sur la base de la valeur de rétention des pics chromatographiques
b, analyse quantitative basée sur la surface ou le pic du pic chromatographique
C. L'efficacité de séparation de la colonne a été évaluée en fonction de la valeur de rétention et de la largeur du pic chromatographique.
La formule de calcul impliquée en chromatographie
1. Valeur de rétention
La valeur de rétention est un paramètre utilisé pour décrire le degré de rétention d'un composant de l'échantillon dans la colonne et est utilisée comme indicateur de caractérisation chromatographique.Son mode de représentation est le suivant :
Temps de rétention tr
Heure de la morttM
Ajuster le temps de rétention tR'=tR-tM
(Temps total passé en phase stationnaire)
Volume de rétention
VR=tR*F. (indépendant de la vitesse de la phase mobile)
Volume mort
VM=tM*Fc
(L'espace non occupé par la phase stationnaire dans le trajet d'écoulement de l'injecteur au détecteur)
Ajuster le volume de rétention VR'=t'R*FC
2. Valeur de rétention relative
La valeur de rétention relative, également connue sous le nom de facteur de séparation, rapport de coefficient de partage ou facteur de capacité relative, est le rapport entre le temps de rétention ajusté (volume) du composant testé et le temps de rétention ajusté (volume) de l'étalon dans certaines conditions chromatographiques.

Les valeurs de rétention relatives ont été utilisées pour éliminer l'influence de certaines conditions opératoires, telles que le débit et la perte de fixateur, sur les valeurs de rétention.L'étalon de la valeur de rétention relative peut être un composant de l'échantillon testé ou un composé ajouté artificiellement.
3. Indice de rétention
L'indice de rétention est l'indice de rétention de la substance i à tester dans une solution fixe X. Deux n-alanes sont sélectionnés comme substances de référence, l'une ayant N nombre de carbones et l'autre ayant N+n.Leur temps de rétention ajusté est respectivement t 'r (N) et t 'r (N+n), de sorte que le temps de rétention ajusté t 'r (i) de la substance i à tester se situe exactement entre eux, c'est-à-dire t'r (N).
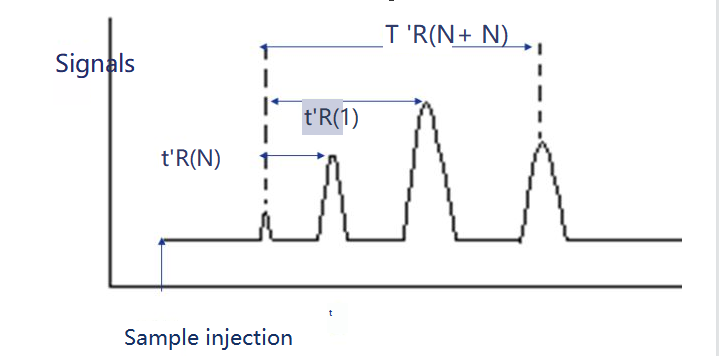
L'indice de rétention peut être calculé comme suit.
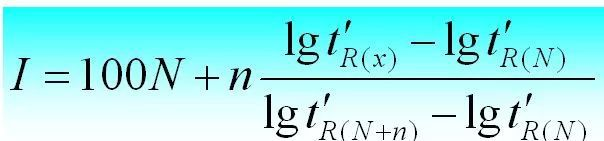
4. Facteur de capacité (k)
À l'équilibre, rapport de la masse d'un composant dans la ou les phases stationnaires à la phase mobile (m), appelé facteur de capacité.La formule est la suivante :
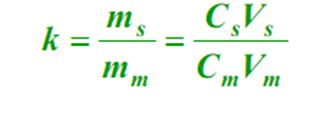
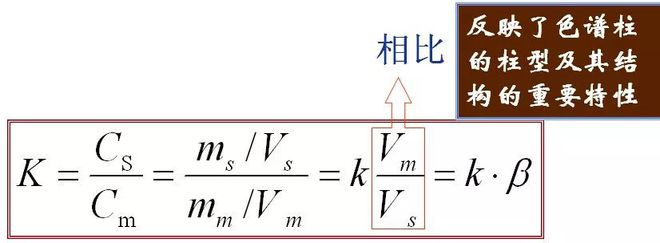
5、Coefficient de partage (K) À l'équilibre, le rapport entre la concentration d'un composant dans la ou les phases stationnaires et la phase mobile (m), appelé coefficient de partage.La formule est la suivante

La relation entre K et k :
Il reflète le type de colonne et ses propriétés importantes de structure de nœud.
bref résumé
Relation entre la valeur de rétention, le facteur de capacité et le coefficient de partage :
La séparation chromatographique est basée sur la différence de capacité d'adsorption ou de dissolution de chaque composant dans un échantillon relatif fixe, qui peut être exprimée quantitativement par la valeur du coefficient de partage K (ou facteur de capacité k).
Les composants ayant une forte capacité d'adsorption ou de dissolution ont un coefficient de partage (ou facteur de capacité) élevé et un long temps de rétention.A l’inverse, les composants à faible adsorption ou solubilité ont un faible coefficient de partage et un temps de rétention court.
Théorie de base de la chromatographie
1. Théorie du plateau
(1) Proposé -- théorie thermodynamique
Tout a commencé avec le modèle de plaque de tour proposé par Martin et Synge.
Colonne de fractionnement : dans le plateau pendant plusieurs fois l'équilibre gaz-liquide, en fonction du point d'ébullition des différentes séparations.
Colonne : Les composants sont équilibrés par plusieurs partitions entre les deux phases et séparés selon différents coefficients de partition.
(2) Hypothèse
(1) Il y a de nombreux plateaux dans la colonne et les composants peuvent rapidement atteindre l'équilibre de distribution dans l'intervalle des plateaux (c'est-à-dire la hauteur du plateau).
(2) La phase mobile entre dans la colonne, non pas en continu mais en pulsation, c'est-à-dire que chaque passage correspond à un volume de colonne.
(3) Lorsque l'échantillon était ajouté à chaque plaque de colonne, la diffusion de l'échantillon le long de l'axe de la colonne pouvait être négligée.
(4) Le coefficient de partage est égal sur tous les plateaux, quelle que soit la quantité de composants.Autrement dit, le coefficient de partage est constant sur chaque taban.
(3) Principe
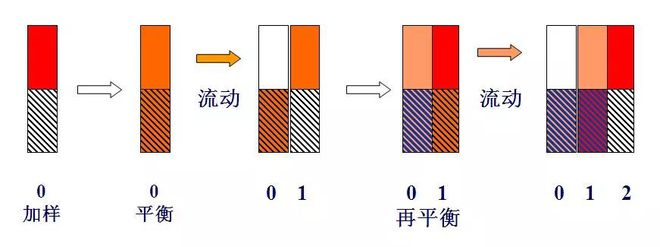
Diagramme schématique de la théorie des plateaux
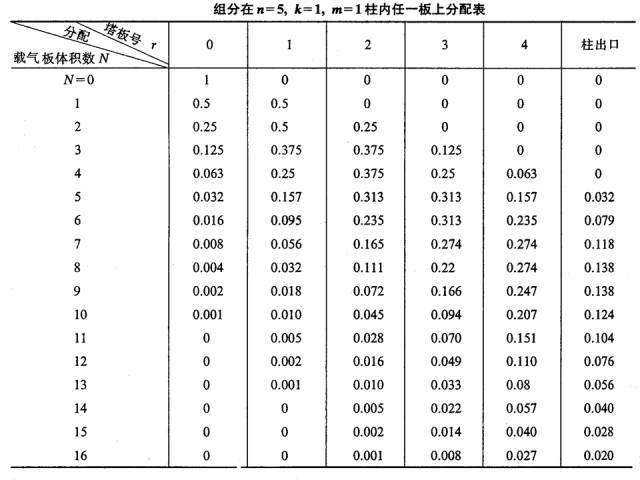
Si un composant de masse unitaire, à savoir m = 1 (par exemple 1 mg ou 1 µg), est ajouté dans le plateau n°0, et après équilibre de répartition, car k = 1, soit ns = nm, nm = ns = 0,5.
Lorsqu'un volume de plaque (lΔV) de gaz porteur pénètre dans la plaque 0 sous forme de pulsation, le gaz porteur contenant le composant nm dans la phase gazeuse est poussé vers la plaque 1. À ce moment, le composant ns dans la phase liquide de la plaque 0 et la composante nm dans la phase gazeuse de la plaque 1 sera redistribuée entre les deux phases.Par conséquent, la quantité totale de composants contenus dans la plaque 0 est de 0,5, dans laquelle les phases gazeuse et liquide sont chacune de 0,25, et la quantité totale contenue dans la plaque 1 est également de 0,5.Les phases gazeuse et liquide étaient également de 0,25.
Ce processus est répété chaque fois qu'un nouveau gaz vecteur de volume de plaque est pulsé dans la colonne (voir tableau ci-dessous).
(4)Équation de la courbe de sortie chromatographique

σ est l'écart type, est le temps de rétention, C est la concentration à tout instant,
C, est la concentration d'injection, c'est-à-dire la quantité totale de composants (surface du pic A).
(5) paramètres d'efficacité de la colonne
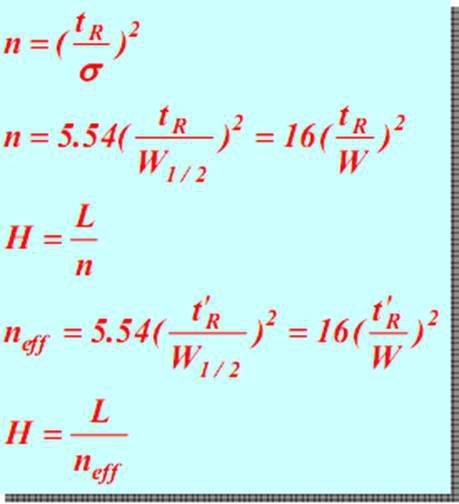
À tR constant, plus W ou w 1/2 est petit (c'est-à-dire le pic le plus étroit), plus le nombre de plateaux théoriques n est grand, plus la hauteur théorique des plateaux est petite et plus l'efficacité de séparation de la colonne est élevée.Il en va de même pour le bac théorique efficace.Le nombre théorique de plateaux est donc un indice pour évaluer l’efficacité des colonnes.
(5) Caractéristiques et lacunes
> Avantages
La théorie du plateau est semi-empirique et explique la forme de la courbe d'écoulement
Les processus de partitionnement et de séparation des composants sont illustrés
Un indice pour évaluer l'efficacité de la colonne est proposé
> Limites
Les composants ne peuvent pas réellement atteindre l'équilibre de répartition dans les deux phases :
La diffusion longitudinale des composants dans la colonne ne peut être ignorée :
L’influence de divers facteurs cinétiques sur le processus de transfert de masse n’a pas été prise en compte.
La relation entre l’effet colonne et la vitesse d’écoulement de la phase mobile ne peut pas être expliquée :
On ne sait pas quels principaux facteurs affectent l'effet de colonne
Ces problèmes sont résolus de manière satisfaisante dans la théorie des taux.
2. Théorie des taux
En 1956, le chercheur néerlandais VanDeemter et al.a absorbé le concept de la théorie du plateau et a combiné les facteurs cinétiques affectant la hauteur du plateau, a proposé la théorie cinétique du processus chromatographique - théorie du taux et a dérivé l'équation de VanDeemter.Il considère le processus chromatographique comme un processus dynamique hors équilibre et étudie l'influence des facteurs cinétiques sur l'élargissement des pics (c'est-à-dire l'effet colonne).
Plus tard, Giddings et Snyder et al.a proposé l'équation du taux de chromatographie liquide (à savoir l'équation de Giddings) basée sur l'équation de VanDeemter (appelée plus tard équation du taux de chromatographie en phase gazeuse) et en fonction de la différence de propriété entre le liquide et le gaz.
(1) Équation de Van Deemter
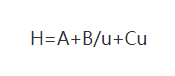
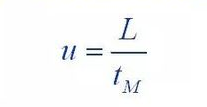
Où : H : est la hauteur de la planche
A : coefficient du terme de diffusion turbulente
B : coefficient de terme de diffusion moléculaire
C : coefficient du terme de résistance au transfert de masse
(2) Équation de Giddings
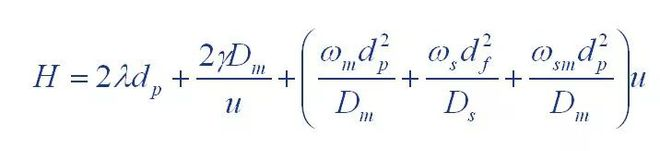
Analyse quantitative et qualitative
(1) Analyse qualitative
L'analyse chromatographique qualitative consiste à déterminer les composés représentés par chaque pic chromatographique.Étant donné que diverses substances ont des valeurs de rétention définies dans certaines conditions chromatographiques, la valeur de rétention peut être utilisée comme indice qualitatif.Diverses méthodes qualitatives chromatographiques sont actuellement basées sur des valeurs de rétention.
Cependant, différentes substances peuvent avoir des valeurs de rétention similaires ou identiques dans les mêmes conditions chromatographiques, c'est-à-dire que les valeurs de rétention ne sont pas exclusives.Il est donc difficile de caractériser un échantillon totalement inconnu sur la base des seules valeurs de rétention.Si, sur la base de la compréhension de la source, de la nature et du but de l'échantillon, un jugement préliminaire de la composition de l'échantillon peut être effectué, et les méthodes suivantes peuvent être utilisées pour déterminer le composé représenté par le pic chromatographique.
1. Contrôle qualitatif utilisant des substances pures
Dans certaines conditions chromatographiques, une inconnue n'a qu'un temps de rétention défini.Par conséquent, l’inconnu peut être identifié qualitativement en comparant le temps de rétention de la substance pure connue dans les mêmes conditions chromatographiques avec le temps de rétention de la substance inconnue.Si les deux sont identiques, la substance inconnue peut être une substance pure connue ;Autrement, l’inconnu n’est pas la substance pure.
La méthode de contrôle des substances pures ne s'applique qu'à la substance inconnue dont la composition est connue, dont la composition est relativement simple et dont la substance pure est connue.
2. Méthode de la valeur de rétention relative
La valeur de rétention relative α fait référence à l'ajustement entre le composant i et les matériaux de référence. Rapport des valeurs de rétention :
Cela ne change qu'avec le changement de fixateur et de température de la colonne, et n'a rien à voir avec d'autres conditions opératoires.
À une certaine température de phase stationnaire et de colonne, les valeurs de rétention ajustées du composant i et de la substance de référence s sont mesurées respectivement, puis calculées selon la formule ci-dessus.Les valeurs de rétention relatives obtenues peuvent être comparées qualitativement aux valeurs correspondantes dans la littérature.
3, ajout de substances connues pour augmenter la méthode de hauteur de pic
Lorsqu'il y a de nombreux composants dans l'échantillon inconnu, les pics chromatographiques obtenus sont trop denses pour être facilement identifiés par la méthode ci-dessus, ou lorsque l'échantillon inconnu est utilisé uniquement pour l'analyse de l'élément spécifié.
"Un chromatogramme d'un échantillon inconnu est d'abord réalisé, puis un autre chromatogramme est obtenu en ajoutant une substance connue à l'échantillon inconnu."Pour ces substances, des composants présentant des hauteurs de pic accrues peuvent être connus.
4. Conserver la méthode qualitative de l'indice
L'indice de rétention représente le comportement de rétention des substances sur les fixateurs et est actuellement l'indice qualitatif le plus largement utilisé et reconnu au niveau international en GC.Il présente les avantages d'une bonne reproductibilité, d'une norme uniforme et d'un faible coefficient de température.
L'indice de rétention est uniquement lié aux propriétés de la phase stationnaire et à la température de la colonne, mais pas aux autres conditions expérimentales.Sa précision et sa reproductibilité sont excellentes.Tant que la température de la colonne est la même que celle de la phase stationnaire, la valeur de la littérature peut être appliquée à des fins d'identification et il n'est pas nécessaire d'utiliser le matériau pur à des fins de comparaison.
(2)Analyse quantitative
Base de la quantification chromatographique :
La tâche de l'analyse quantitative est de trouver la centaine de composants dans l'échantillon mixte
Contenu fractionné.La quantification chromatographique était basée sur les éléments suivants : lorsque les conditions opératoires étaient cohérentes,
La masse (ou concentration) du composant mesuré est déterminée par le signal de réponse donné par le détecteur
C'est proportionnel.À savoir:
Base de la quantification chromatographique :
La tâche de l'analyse quantitative est de trouver la centaine de composants dans l'échantillon mixte
Contenu fractionné.La quantification chromatographique était basée sur les éléments suivants : lorsque les conditions opératoires étaient cohérentes,
La masse (ou concentration) du composant mesuré est déterminée par le signal de réponse donné par le détecteur
C'est proportionnel.À savoir:
1. Méthode de mesure de la surface des pics
La surface des pics correspond aux données quantitatives de base fournies par les chromatogrammes, et la précision de la mesure de la surface des pics affecte directement les résultats quantitatifs.Différentes méthodes de mesure ont été utilisées pour les pics chromatographiques présentant différentes formes de pics.
Il est difficile de trouver la valeur exacte de l’hiver en analyse quantitative :
D'une part en raison de la difficulté de mesurer avec précision le volume absolu d'injection : d'autre part
La surface du pic dépend des conditions chromatographiques et la bande chromatographique doit être conservée lorsque la valeur est mesurée.
Il n’est ni possible ni pratique de faire la même chose.Et même si tu peux bien faire les choses
La valeur exacte, également parce qu’il n’existe pas de norme unifiée et ne peut pas être directement appliquée.
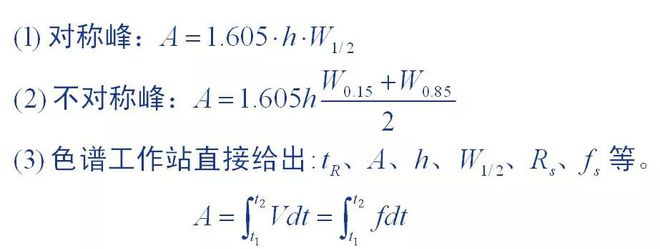
2. Facteur de correction quantitative
Définition du facteur de correction quantitatif : quantité de composants entrant dans le détecteur (m)
Le rapport entre la surface du pic chromatographique (A) ou la hauteur du pic () est une constante de proportionnalité (,
La constante de proportionnalité est appelée facteur de correction absolu de la composante.
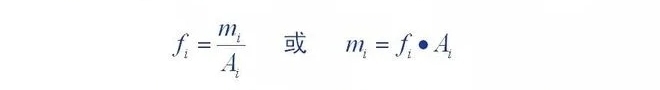
Il est difficile de trouver la valeur exacte de l’hiver en analyse quantitative :
D'une part en raison de la difficulté de mesurer avec précision le volume absolu d'injection : d'autre part
La surface du pic dépend des conditions chromatographiques et la bande chromatographique doit être conservée lorsque la valeur est mesurée.
Il n’est ni possible ni pratique de faire la même chose.Et même si tu peux bien faire les choses
La valeur exacte, également parce qu’il n’existe pas de norme unifiée et ne peut pas être directement appliquée.
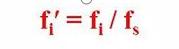
C'est-à-dire que le facteur de correction relatif d'un composant est le composant et le matériau de référence s
Le rapport des facteurs de correction absolus.
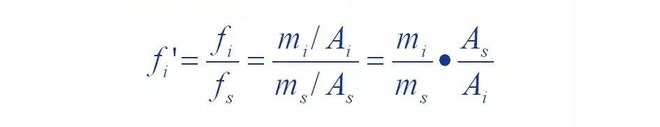
On peut voir que le facteur de correction relatif correspond à la qualité du composant par rapport à la norme.
Lorsque la substance s est égale, l'aire du pic du matériau de référence est l'aire du pic du composant
Plusieurs.Si un composant a une masse m et une aire de pic A, alors le nombre de f'A
Les valeurs sont égales à la surface du pic du matériau de référence avec une masse de.Autrement dit,
Grâce au facteur de correction relative, les zones de pic de chaque composant peuvent être séparées
Converti en surface du pic du matériau de référence égale à sa masse, puis le rapport
La norme est unifiée.C'est donc la méthode normalisée pour déterminer le pourcentage de chaque composant
La base de la quantité.
Méthode d'obtention du facteur de correction relatif : les valeurs du facteur de correction relatif ont été comparées uniquement à
La mesure est liée au standard et au type de détecteur, mais à la bandelette de fonctionnement
Cela n'a pas d'importance.Les valeurs peuvent donc être extraites des références de la littérature.Si le texte
Si vous ne trouvez pas la valeur souhaitée dans l'offre, vous pouvez également la déterminer vous-même.Méthode de détermination
Méthode : Une certaine quantité de la substance mesurée dix matériaux de référence sélectionnés → transformée en une certaine concentration
Les surfaces des pics chromatographiques A et As des deux composants ont été mesurées.
C'est la formule.
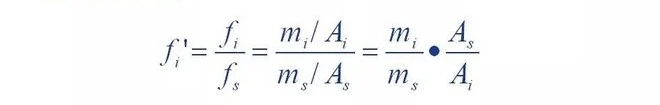
3. Méthode de calcul quantitatif
(1) Méthode de normalisation de zone
La somme du contenu de toutes les fractions sans pic a été calculée à 100 % pour la quantification.
La méthode est appelée normalisation.Sa formule de calcul est la suivante :
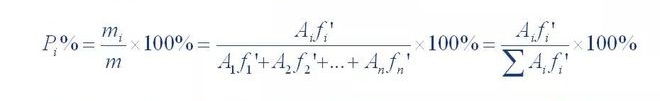
Où P,% est la teneur en pourcentage des composants testés ;A1, A2... A n est le composant 1. La surface du pic de 1~n ;f'1, f'2... f'n est le facteur de correction relatif pour les composantes 1 à n.
(2) méthode standard externe
Méthode de comparaison quantitative entre le signal de réponse du composant à tester dans l'échantillon et le composant pur à tester comme contrôle.
(3) Méthode standard interne
La méthode dite d'étalon interne est une méthode dans laquelle une certaine quantité de substance pure est ajoutée à la solution étalon de la substance testée et à la solution échantillon en tant qu'étalon interne, puis analysée et déterminée.
(3) méthode d'addition standard
La méthode d'addition standard, également connue sous le nom de méthode d'addition interne, consiste à ajouter une certaine quantité de (△C)
La référence de la substance testée a été ajoutée à la solution échantillon à tester et le test a été ajouté au test.
Le pic de la solution échantillon après la substance était supérieur à celui de la solution échantillon d'origine
L'incrément de surface (△A) a été utilisé pour calculer la concentration de la substance dans la solution échantillon.
Contenu (Cx)
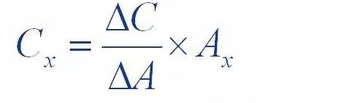
Où Axe est la surface maximale de la substance à mesurer dans l’échantillon d’origine.

Heure de publication : 27 mars 2023